Membrangebundene CPX-ATPasen
Schwermetalle transportierende ATPasen sind integrale Membranproteine, die eine wichtige Rolle in der Regulation der intrazellulären Konzentrationen von Kupfer, Zink und anderen Metallen (in ionischer Form) spielen. Manche Schwermetalle sind bereits in niedrigen Konzentrationen toxisch: Die Zelle setzt zur Entgiftung bestimmte ATPasen ein, die das Cytoplasma spezifisch von den eingeschwemmten Schwermetallen befreien (siehe folgende Abbildung). Diese Membranproteine sind also für die zelluläre Schwermetallresistenz zuständig. Es existieren separate Transporter (= Exporter) für Kupfer, Zink, Blei, Silber, Cadmium und Kobalt.
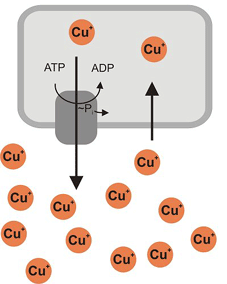
Bakterieller Export von Kupfer-Ionen
Die CPX-ATPasen (die Bezeichnung "CPX" rührt von einem konservierten Aminosäure-Seqenzmotiv Cystein-Prolin-X, wobei X für Cystein oder eine andere beliebige Aminosäure steht) gehören zur Superfamilie der so genannten P-Typ ATPasen. Sie beziehen die für die Transportleistung (entgegen dem Konzentrationsgradienten der Metalle) erforderliche Energie aus der Hydrolyse von ATP. In ihrem katalytischen Reaktionszyklus bilden die ATPasen ein Zwischenprodukt, bei dem das Protein einen Komplex mit der kovalent gebundenen Phosphatgruppe bildet (daher der Name "P-Typ" ATPase).
Die Calcium-ATPase gilt als "Prototyp" der P-Typ ATPasen. Ihre 3D-Struktur wurde durch Röntgenkristallographie aufgeklärt (siehe nächste Abbildung). Der Grad an Sequenzverwandtschaft zu den CPX-ATPasen ist jedoch zu niedrig, dass man die Struktur der Calcium-ATPase nicht zur Modellbildung heranziehen kann. Wir arbeiten daran, verschiedene für Schwermetall-translozierende CPX-ATPasen codierende Gene aus Archaeen und Eubakterien in Escherichia coli heterolog zu exprimieren und die Produkte zu reinigen. Unser Ziel ist die Aufklärung von Struktur und Funktion dieser Transportermoleküle.
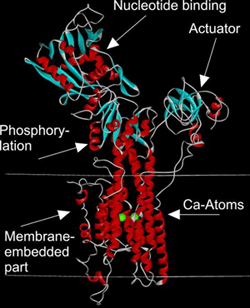
Calcium-ATPase als Prototyp von P-Typ ATPasen
(Die Koordinaten zur Darstellung der Molekülstruktur wurden entnommen aus Toyoshima et al. (2000) Nature 405, 647-655)